Wort Des Generalverwalter
Liebe Leserin, lieber Leser,
wie andere Akteure müssen sich auch öffentliche Institutionen regelmäßig auf aktuelle Ereignisse und die damit verbundenen Herausforderungen einstellen. Dies war bei der Föderalen Agentur für Arzneimittel und Gesundheitsprodukte (FAAG) 2024 der Fall. Mit dem Engagement für die belgische Bevölkerung und die medizinischen Fachkräfte sowie der Zusammenarbeit auf nationaler und europäischer Ebene hatten unsere Mitarbeiter alle Hände voll zu tun. Jedes Projekt – unabhängig von seiner Größe – wurde ernsthaft betrieben, ohne jemals das Gemeinwohl aus den Augen zu verlieren.
In diesem Sinne möchte ich Ihnen unseren Jahresbericht 2024 vorstellen. Er bietet einen Überblick über ein arbeitsreiches Jahr. Wir konnten darin nicht alle Verdienste der Agentur detailliert aufführen. Wir haben uns jedoch bemüht, die groben Züge wiederzugeben. Sie werden feststellen, dass die Darstellung eine andere ist als in den Vorjahren. Wir haben uns für einen neuen, zugänglicheren Ansatz entschieden. Wir hoffen, dass dieses Format Ihnen zusagt. Wir laden Sie übrigens ein, uns Ihre Meinung per E-Mail mitzuteilen.
In Belgien begann das Jahr 2024 mit einem Paukenschlag, da unser Land den Vorsitz im Rat der Europäischen Union innehatte. Trotz Vorbereitung hat dieser Vorsitz unsere Teams im ersten Halbjahr stark beansprucht, insbesondere durch die Organisation von Veranstaltungen, Treffen und die Koordination von Arbeitsgruppen. Die Bilanz, die über unsere Aktivitäten hinausgeht, ist positiv und zeugt vom Engagement unserer Mitarbeiterinnen und Mitarbeiter für die europäischen Herausforderungen.
Gleichzeitig stand unser Hauptziel – die öffentliche Gesundheit – weiterhin ganz oben auf unserer Agenda. Hier einige Beispiele.
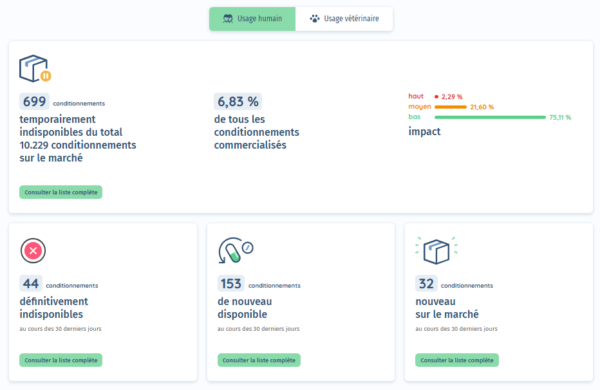
Besondere Aufmerksamkeit galt der Verfügbarkeit von Medikamenten. Die Task Force Indisponibilité war an mehreren Fronten aktiv: gesetzlicher Rahmen, Austausch mit Gesundheitsfachkräften und Patienten, europäische Koordination … um die geeignetsten Lösungen anzubieten, die der Realität in der Praxis entsprechen.
Im Sinne einer kontinuierlichen Verbesserung hat die FAAG mehrere Anwendungen entwickelt und optimiert, die den Alltag von medizinischen Fachkräften und Patienten erleichtern sollen: Pharmastatut, PharmaInfo, die Arzneimitteldatenbank, das Apothekenkataster, Narcoreg usw.
Unsere Mitarbeiter in der Pharmakovigilanz organisierten ihrerseits ein Webinar über künstliche Intelligenz, um über den sinnvollen Einsatz dieser neuen Technologie nachzudenken, die, wenn sie richtig eingesetzt wird, ein wertvolles Hilfsmittel in ihrem Bereich sein könnte.
Die FAAG hat auch zur Bekämpfung der Blauzungenkrankheit und des Virus der epizootischen hämorrhagischen Krankheit beigetragen, indem sie Impfstoffe gegen diese Krankheiten genehmigt hat, insbesondere über Dringlichkeitsverfahren. Dadurch konnten der Veterinärsektor und die Tierhalter angesichts potenziell verheerender Krankheiten unterstützt werden.
Intern setzten wir unsere Modernisierungsbemühungen fort. Wir überprüften unser Organigramm und erstellten unseren Strategieplan 2025-2027.
Unser in Belgien und international anerkanntes Fachwissen (insbesondere im Bereich der Impfstoffe) beruht auf den Fähigkeiten und dem Engagement unserer Mitarbeiterinnen und Mitarbeiter. Ich möchte ihnen daher herzlich für ihr Engagement und ihre Motivation danken. Ihnen allen und unseren Partnern ist es zu verdanken, dass wir uns für den Schutz der öffentlichen Gesundheit einsetzen.
Ich wünsche Ihnen viel Spaß beim Lesen.
Hugues Malonne
Generalverwalter der FAAG
Der Vorsitz im Rat der Europäischen Union
Der Vorsitz im Rat der Europäischen Union
Kalender der Präsidentschaft
24. – 25. Januar 2024
Virtuelle Tagung der HMA
Der belgische Vorsitz begann für die FAAG offiziell mit der virtuellen Tagung des Netzwerks der Direktoren der europäischen Arzneimittelagenturen (Heads of Medicines Agencies, HMA).
Diese Tagung stand ganz im Zeichen der neuen „Critical Medicines Alliance“, einem Konsultationsmechanismus, der alle relevanten Interessengruppen zusammenbringt, um Arzneimittelengpässe besser zu verhindern und zu beheben.
22. – 23. Februar 2024
IT Directors Group
Technologie spielt eine immer wichtigere Rolle im Gesundheitswesen. Während des Treffens der IT Directors Group wurde erörtert, wie die Agenturen bei Digitalisierung und IT noch besser zusammenarbeiten können.
Ein wichtiger Tagesordnungspunkt war die Frage, wie die zuständigen nationalen Behörden bei den technologischen Veränderungen unterstützt werden können, die in den kommenden Jahren auf sie zukommen.

14. – 15. März 2024
CEG-CAMD
Die für Medizinprodukte und In-vitro-Diagnostika zuständigen europäischen Behörden trafen sich für die Tagung der CEG und CAMD (CAMD Executive Group and Competent Authorities for Medical Devices).
Auf der Tagesordnung standen wichtige Themen wie der Mangel an Medizinprodukten und der Einsatz von in-house In-vitro-Diagnostika. Die FAAG hatte die Gelegenheit, einige der jüngsten Errungenschaften auf dem Gebiet der Medizinprodukte vorzustellen.

28. – 29. März 2024
COMP
Der Ausschuss für Arzneimittel für seltene Leiden (Committee for Orphan Medicinal Products, COMP) spielt eine Schlüsselrolle bei der Verbesserung des Zugangs zu sicheren und wirksamen Behandlungen für Patienten mit seltenen Krankheiten. Während des belgischen Vorsitzes wurde die Zusammenarbeit im Ausschuss weiter vertieft. Ein wichtiger Tagesordnungspunkt war die Einführung des Konzepts des „ungedeckten medizinischen Bedarfs“ im Rahmen der Überarbeitung des europäischen Arzneimittelrechts.

10. – 11. April 2024
CMD-v-CVMP
Das CVMP (Committee for Veterinary Medicinal Products) und die CMDv (Coordination Group for Mutual Recognition and Decentralised Procedures for Veterinary Medicinal Products) − die europäischen Arbeitsgruppen für Tierarzneimittel − haben auf einer gemeinsamen Sitzung verschiedene Themen besprochen. Im Mittelpunkt standen Themen wie multinationale klinische Studien an Tieren, die Regulierung von Tierarzneimitteln und die Praktikabilität elektronischer Packungsbeilagen. Darüber hinaus tauschten sich die Experten über neu auftretende Tierkrankheiten, die Nutzung von Big Data und künstlicher Intelligenz, die Notwendigkeit von Schulungen und die Rolle von Biosimilars in der Tiermedizin aus.

18. April 2024
Erste gemeinsame Sitzung von NCAPR, HTA- HAG und HMA
Die FAAG hatte die Ehre, Gastgeberin der ersten gemeinsamen Sitzung der Heads of Medicines Agencies (HMA), der National Competent Authorities on Pricing and Reimbursement (NCAPR) und der Heads of HTA Agencies (HAG) zu sein.
Die Teilnehmer diskutierten unter anderem über die Wiederverwendung bestehender Arzneimittel und die Deckung des medizinischen Bedarfs, der heute noch nicht gedeckt ist. Auch die gemeinsame Beschaffung und Verhandlungen wurden erörtert, wobei der Kampf gegen die Antibiotikaresistenz und der Zugang zu innovativen Medizinprodukten und Diagnostika im Vordergrund standen.

23. April 2024
Start der Critical Medicines Alliance
Der offizielle Start der Critical Medicines Alliance brachte alle relevanten Interessengruppen für ein gemeinsames Ziel zusammen: die Verbesserung der Versorgung mit unentbehrlichen Arzneimitteln in Europa.
Durch die Identifizierung vorrangiger Maßnahmen will das Bündnis Engpässen vorbeugen und sie wirksamer beheben.
Die FAAG spielte eine aktive Rolle, sowohl durch interne Experten als auch durch den Lenkungsausschuss, in dem Hugues Malonne als Vizepräsident fungierte.

16. – 17. Mai 2024
PDCO-CAT
Experten des PDCO (Paediatric Committee) und des CAT (Committee for Advanced Therapies) waren zusammen mit Vertretern von Patientenorganisationen, der Wissenschaft, der Gesundheitstechnologiebewertung (HTA), der Europäischen Arzneimittelagentur (EMA) und der zuständigen nationalen Behörden anwesend. Diskutiert wurden unter anderem der ungedeckte medizinische Bedarf und die Entwicklung neuartiger Therapien (ATMPs) für die pädiatrische Onkologie und neuromuskuläre Störungen bei Kindern.

28. – 29. Mai 2024
PRAC
Das Pharmacovigilance Risk Assessment Committee (PRAC) tritt monatlich zusammen, um alle Aspekte des Risikomanagements für Humanarzneimittel zu überprüfen.
Während dieser Tagung wurde eine Vielzahl von Themen behandelt, darunter der Einsatz künstlicher Intelligenz zur Unterstützung der Pharmakovigilanz, Risiken von Arzneimitteln während der Schwangerschaft und die Vorbereitung von Bewertungsteams auf Krisensituationen.

4. – 5. Juni 2024
SAWP-CHMP
Die Co-ordination Group for Mutual Recognition and Decentralised Procedures – Human (CMDh) spielt weiterhin eine Schlüsselrolle bei der Verbesserung der Arzneimittelzulassungsverfahren in Europa.
Zu den Themen der Tagung gehörten die Überprüfung der europäischen Arzneimittelgesetzgebung, die Überwachung von Arzneimittelengpässen und der Austausch von Erfahrungen mit nationalen Arzneimitteldatenbanken.

25. – 26. Juni 2024
HMPWG
Die Homeopathic Medicinal Product Working Group (HMPWG) traf sich, um eine Reihe wichtiger Themen zu besprechen. Auf der Tagesordnung stand die Wiederaufnahme der Arbeit der Untergruppe für die Sicherheit homöopathischer Arzneimittel. Außerdem wurde an einem aktualisierten Frage-Antwort-Dokument gearbeitet, in das die neuesten europäischen Verordnungen über Tierarzneimittel eingearbeitet wurden.

30. – 31. Januar 2024
3R-Workshop und -Konferenz
Ein interaktiver Workshop über mikrophysiologische Systeme brachte Forscher, politische Entscheidungsträger, die pharmazeutische Industrie und Entwickler zusammen, um mehr Einblick in diese vielversprechende Technologie zu erhalten. Am nächsten Tag fand eine Konferenz über die 3R-Prinzipien − Replacement, Reduction und Refinement − bei Tierversuchen in der Arzneimittelforschung statt.

6. – 7. März 2024
Clinical Trials Coordination Group
Die Koordinierungsgruppe für klinische Prüfungen (Clinical Trials Coordination Group, CTCG) erörterte wichtige Themen, darunter die Umstellung laufender klinischer Prüfungen auf die neue europäische Verordnung. Sie beurteilte auch die Fortschritte von Projekten zur Beschleunigung der Bewertung klinischer Versuche in Krisensituationen, wie COVID-19. Schließlich wurde die Möglichkeit einer frühzeitigen wissenschaftlichen Beratung bei der Einreichung von Anträgen auf klinische Prüfungen erörtert und wie sich dies mit den bestehenden Beratungsverfahren vereinbaren ließe.

27. März 2024
Besuch von Emer Cooke von der Europäischen Arzneimittelbehörde
Ein besonderer Tag für die FAAG: Emer Cooke, Exekutivdirektorin der Europäischen Arzneimittelagentur, besuchte die Agentur. Während ihres Besuchs tauschte sie sich mit den Mitarbeitern über Themen wie Arzneimittelknappheit, europäische Zusammenarbeit und die Überarbeitung des Arzneimittelrechts aus. Sie würdigte das große Engagement der FAAG-Mitarbeiter innerhalb des EMA-Netzwerks. Der Besuch unterstrich einmal mehr die Bedeutung einer engen europäischen Zusammenarbeit im Gesundheitswesen.

4. – 5. April 2024
EMACOLEX
Auf der EMACOLEX-Tagung (Co-operation of Legal and Legislative Issues) kamen Rechtsexperten aus verschiedenen Ländern zusammen, um aktuelle Themen zu erörtern.
Die Überprüfung der europäischen Arzneimittelgesetzgebung und die Arzneimittelknappheit wurden ausführlich erörtert. Darüber hinaus gab es interessante Präsentationen über Parallelimporte.

17. – 18. April 2024
Konferenz über unerfüllte Gesundheitsbedürfnisse
In Zusammenarbeit mit dem Landesinstitut für Kranken- und Invaliditätsversicherung (LIKIV) und dem Föderalen Fachzentrum für Gesundheitswesen (KCE) organisierte die FAAG eine Konferenz zum Thema ungedeckter gesundheitsbezogener Bedürfnisse.
Der Schwerpunkt lag auf der Ermittlung der Bedürfnisse aus der Sicht der Patienten und der Gesellschaft. Es wurde untersucht, wo der Bedarf am größten ist und wie er besser gedeckt werden könnte − zum Beispiel durch eine europäische Forschungsinfrastruktur oder einen von den Mitgliedstaaten gesteuerten Bewertungsmechanismus.
Diese Konferenz ist ein wichtiger Schritt auf dem Weg zu einer stärker bedarfsorientierten Entscheidungsfindung, sowohl innerhalb der EU als auch auf nationaler Ebene.

19. April 2024
Zweite Sitzung der HMA
Unser Generalverwalter Hugues Malonne leitete die zweite Plenarsitzung der HMA des belgischen Ratsvorsitzes. Vertreter von Arzneimittelagenturen aus ganz Europa, der Europäischen Arzneimittelagentur und der Europäischen Kommission nahmen aktiv an den Diskussionen teil.
Der Schwerpunkt lag auf der Stärkung des europäischen Netzwerks für die Arzneimittelzulassung und der Rolle der künstlichen Intelligenz im Rahmen der Arzneimittelzulassung.

24. – 25. April 2024
HMPC
Auf der Sitzung des Ausschusses für pflanzliche Arzneimittel (Committee on Herbal Medicinal Products, HMPC) kamen europäische Experten zusammen, um wissenschaftliche Daten über pflanzliche Stoffe, Zubereitungen und Kombinationen zu prüfen.
Auf der Tagesordnung standen Produkte aus der Grauzone und die antimikrobielle Wirkung von Pflanzenbestandteilen. Auch strategische Diskussionen über künftige Herausforderungen standen im Mittelpunkt.

23. – 24. Mai 2024
WGCP
Bei der Sitzung der Arbeitsgruppe der Kommunikationsfachleute (Working Group of Communications Professionals, WGCP) wurden die gemeinsame Kommunikationsstrategie der europäischen Arzneimittelagenturen weiterentwickelt und konkrete Maßnahmen zur Verbesserung der Information von Patienten und Interessengruppen vorbereitet. Darüber hinaus wurden inspirierende Beispiele vorgestellt, wie die belgische Patienten-Website FarmaInfo und die niederländische Kampagne zu Wechselwirkungen zwischen Medikamenten und Pflanzen.

29. – 31. Mai 2024
WGEO
Die Working Group of Enforcement Officers (WGEO) brachte Vollzugsbeamte aus ganz Europa zusammen, um Erfahrungen und Informationen im Kampf gegen illegale und gefälschte Arzneimittel auszutauschen.
Auf der Tagesordnung standen eine Präsentation der belgischen Durchsetzungsmaßnahmen sowie eine Sitzung zum Thema Online-Werbung und -Verkauf sogenannter „Hot Medicines“ wie Ozempic und Botox. Diese Zusammenarbeit trägt direkt zum Schutz der Volksgesundheit bei.

11. – 12. Juni 2024
CMD-h
Die CMD-h (Co-ordination Group for Mutual Recognition and Decentralised procedures – Human) spielt eine wesentliche Rolle bei der kontinuierlichen Verbesserung des Zulassungsverfahrens für Arzneimittel.
Auf der Tagesordnung standen wichtige Themen wie die Überprüfung der europäischen Arzneimittelgesetzgebung, der Austausch nationaler Erfahrungen, einschließlich nationaler Arzneimitteldatenbanken und die Überwachung von Nichtverfügbarkeit und IncreaseNet: eine gemeinsame Aktion, die darauf abzielt, die Kapazitäten innerhalb des europäischen Netzwerks für Arzneimittelregulierung zu erhöhen.

27. – 28. Juni 2024
WGQM
Die Working Group of Quality Managers (WGQM), die zum HMA-Netzwerk gehört, konzentriert sich auf die Erstellung und Verbesserung von Qualitätsrichtlinien für die europäischen Arzneimittelbehörden.
Im Mittelpunkt des Treffens standen die Themen kontinuierliche Verbesserung, Risikomanagement, Prozessoptimierung und Audits – alles entscheidende Elemente, um die Prozesse in Unternehmen effizienter und effektiver zu gestalten.
Schließlich ist eine starke Qualitätskultur die Grundlage für eine zuverlässige und transparente Regulierung.

24. – 25. Januar 2024
Virtuelle Tagung der HMA
Der belgische Vorsitz begann für die FAAG offiziell mit der virtuellen Tagung des Netzwerks der Direktoren der europäischen Arzneimittelagenturen (Heads of Medicines Agencies, HMA).
Diese Tagung stand ganz im Zeichen der neuen „Critical Medicines Alliance“, einem Konsultationsmechanismus, der alle relevanten Interessengruppen zusammenbringt, um Arzneimittelengpässe besser zu verhindern und zu beheben.
30. – 31. Januar 2024
3R-Workshop und -Konferenz
Ein interaktiver Workshop über mikrophysiologische Systeme brachte Forscher, politische Entscheidungsträger, die pharmazeutische Industrie und Entwickler zusammen, um mehr Einblick in diese vielversprechende Technologie zu erhalten. Am nächsten Tag fand eine Konferenz über die 3R-Prinzipien − Replacement, Reduction und Refinement − bei Tierversuchen in der Arzneimittelforschung statt.

22. – 23. Februar 2024
IT Directors Group
Technologie spielt eine immer wichtigere Rolle im Gesundheitswesen. Während des Treffens der IT Directors Group wurde erörtert, wie die Agenturen bei Digitalisierung und IT noch besser zusammenarbeiten können.
Ein wichtiger Tagesordnungspunkt war die Frage, wie die zuständigen nationalen Behörden bei den technologischen Veränderungen unterstützt werden können, die in den kommenden Jahren auf sie zukommen.

6. – 7. März 2024
Clinical Trials Coordination Group
Die Koordinierungsgruppe für klinische Prüfungen (Clinical Trials Coordination Group, CTCG) erörterte wichtige Themen, darunter die Umstellung laufender klinischer Prüfungen auf die neue europäische Verordnung. Sie beurteilte auch die Fortschritte von Projekten zur Beschleunigung der Bewertung klinischer Versuche in Krisensituationen, wie COVID-19. Schließlich wurde die Möglichkeit einer frühzeitigen wissenschaftlichen Beratung bei der Einreichung von Anträgen auf klinische Prüfungen erörtert und wie sich dies mit den bestehenden Beratungsverfahren vereinbaren ließe.

14. – 15. März 2024
CEG-CAMD
Die für Medizinprodukte und In-vitro-Diagnostika zuständigen europäischen Behörden trafen sich für die Tagung der CEG und CAMD (CAMD Executive Group and Competent Authorities for Medical Devices).
Auf der Tagesordnung standen wichtige Themen wie der Mangel an Medizinprodukten und der Einsatz von in-house In-vitro-Diagnostika. Die FAAG hatte die Gelegenheit, einige der jüngsten Errungenschaften auf dem Gebiet der Medizinprodukte vorzustellen.

27. März 2024
Besuch von Emer Cooke von der Europäischen Arzneimittelbehörde
Ein besonderer Tag für die FAAG: Emer Cooke, Exekutivdirektorin der Europäischen Arzneimittelagentur, besuchte die Agentur. Während ihres Besuchs tauschte sie sich mit den Mitarbeitern über Themen wie Arzneimittelknappheit, europäische Zusammenarbeit und die Überarbeitung des Arzneimittelrechts aus. Sie würdigte das große Engagement der FAAG-Mitarbeiter innerhalb des EMA-Netzwerks. Der Besuch unterstrich einmal mehr die Bedeutung einer engen europäischen Zusammenarbeit im Gesundheitswesen.

28. – 29. März 2024
COMP
Der Ausschuss für Arzneimittel für seltene Leiden (Committee for Orphan Medicinal Products, COMP) spielt eine Schlüsselrolle bei der Verbesserung des Zugangs zu sicheren und wirksamen Behandlungen für Patienten mit seltenen Krankheiten. Während des belgischen Vorsitzes wurde die Zusammenarbeit im Ausschuss weiter vertieft. Ein wichtiger Tagesordnungspunkt war die Einführung des Konzepts des „ungedeckten medizinischen Bedarfs“ im Rahmen der Überarbeitung des europäischen Arzneimittelrechts.

4. – 5. April 2024
EMACOLEX
Auf der EMACOLEX-Tagung (Co-operation of Legal and Legislative Issues) kamen Rechtsexperten aus verschiedenen Ländern zusammen, um aktuelle Themen zu erörtern.
Die Überprüfung der europäischen Arzneimittelgesetzgebung und die Arzneimittelknappheit wurden ausführlich erörtert. Darüber hinaus gab es interessante Präsentationen über Parallelimporte.

10. – 11. April 2024
CMD-v-CVMP
Das CVMP (Committee for Veterinary Medicinal Products) und die CMDv (Coordination Group for Mutual Recognition and Decentralised Procedures for Veterinary Medicinal Products) − die europäischen Arbeitsgruppen für Tierarzneimittel − haben auf einer gemeinsamen Sitzung verschiedene Themen besprochen. Im Mittelpunkt standen Themen wie multinationale klinische Studien an Tieren, die Regulierung von Tierarzneimitteln und die Praktikabilität elektronischer Packungsbeilagen. Darüber hinaus tauschten sich die Experten über neu auftretende Tierkrankheiten, die Nutzung von Big Data und künstlicher Intelligenz, die Notwendigkeit von Schulungen und die Rolle von Biosimilars in der Tiermedizin aus.

17. – 18. April 2024
Konferenz über unerfüllte Gesundheitsbedürfnisse
In Zusammenarbeit mit dem Landesinstitut für Kranken- und Invaliditätsversicherung (LIKIV) und dem Föderalen Fachzentrum für Gesundheitswesen (KCE) organisierte die FAAG eine Konferenz zum Thema ungedeckter gesundheitsbezogener Bedürfnisse.
Der Schwerpunkt lag auf der Ermittlung der Bedürfnisse aus der Sicht der Patienten und der Gesellschaft. Es wurde untersucht, wo der Bedarf am größten ist und wie er besser gedeckt werden könnte − zum Beispiel durch eine europäische Forschungsinfrastruktur oder einen von den Mitgliedstaaten gesteuerten Bewertungsmechanismus.
Diese Konferenz ist ein wichtiger Schritt auf dem Weg zu einer stärker bedarfsorientierten Entscheidungsfindung, sowohl innerhalb der EU als auch auf nationaler Ebene.

18. April 2024
Erste gemeinsame Sitzung von NCAPR, HTA- HAG und HMA
Die FAAG hatte die Ehre, Gastgeberin der ersten gemeinsamen Sitzung der Heads of Medicines Agencies (HMA), der National Competent Authorities on Pricing and Reimbursement (NCAPR) und der Heads of HTA Agencies (HAG) zu sein.
Die Teilnehmer diskutierten unter anderem über die Wiederverwendung bestehender Arzneimittel und die Deckung des medizinischen Bedarfs, der heute noch nicht gedeckt ist. Auch die gemeinsame Beschaffung und Verhandlungen wurden erörtert, wobei der Kampf gegen die Antibiotikaresistenz und der Zugang zu innovativen Medizinprodukten und Diagnostika im Vordergrund standen.

19. April 2024
Zweite Sitzung der HMA
Unser Generalverwalter Hugues Malonne leitete die zweite Plenarsitzung der HMA des belgischen Ratsvorsitzes. Vertreter von Arzneimittelagenturen aus ganz Europa, der Europäischen Arzneimittelagentur und der Europäischen Kommission nahmen aktiv an den Diskussionen teil.
Der Schwerpunkt lag auf der Stärkung des europäischen Netzwerks für die Arzneimittelzulassung und der Rolle der künstlichen Intelligenz im Rahmen der Arzneimittelzulassung.

23. April 2024
Start der Critical Medicines Alliance
Der offizielle Start der Critical Medicines Alliance brachte alle relevanten Interessengruppen für ein gemeinsames Ziel zusammen: die Verbesserung der Versorgung mit unentbehrlichen Arzneimitteln in Europa.
Durch die Identifizierung vorrangiger Maßnahmen will das Bündnis Engpässen vorbeugen und sie wirksamer beheben.
Die FAAG spielte eine aktive Rolle, sowohl durch interne Experten als auch durch den Lenkungsausschuss, in dem Hugues Malonne als Vizepräsident fungierte.

24. – 25. April 2024
HMPC
Auf der Sitzung des Ausschusses für pflanzliche Arzneimittel (Committee on Herbal Medicinal Products, HMPC) kamen europäische Experten zusammen, um wissenschaftliche Daten über pflanzliche Stoffe, Zubereitungen und Kombinationen zu prüfen.
Auf der Tagesordnung standen Produkte aus der Grauzone und die antimikrobielle Wirkung von Pflanzenbestandteilen. Auch strategische Diskussionen über künftige Herausforderungen standen im Mittelpunkt.

16. – 17. Mai 2024
PDCO-CAT
Experten des PDCO (Paediatric Committee) und des CAT (Committee for Advanced Therapies) waren zusammen mit Vertretern von Patientenorganisationen, der Wissenschaft, der Gesundheitstechnologiebewertung (HTA), der Europäischen Arzneimittelagentur (EMA) und der zuständigen nationalen Behörden anwesend. Diskutiert wurden unter anderem der ungedeckte medizinische Bedarf und die Entwicklung neuartiger Therapien (ATMPs) für die pädiatrische Onkologie und neuromuskuläre Störungen bei Kindern.

23. – 24. Mai 2024
WGCP
Bei der Sitzung der Arbeitsgruppe der Kommunikationsfachleute (Working Group of Communications Professionals, WGCP) wurden die gemeinsame Kommunikationsstrategie der europäischen Arzneimittelagenturen weiterentwickelt und konkrete Maßnahmen zur Verbesserung der Information von Patienten und Interessengruppen vorbereitet. Darüber hinaus wurden inspirierende Beispiele vorgestellt, wie die belgische Patienten-Website FarmaInfo und die niederländische Kampagne zu Wechselwirkungen zwischen Medikamenten und Pflanzen.

28. – 29. Mai 2024
PRAC
Das Pharmacovigilance Risk Assessment Committee (PRAC) tritt monatlich zusammen, um alle Aspekte des Risikomanagements für Humanarzneimittel zu überprüfen.
Während dieser Tagung wurde eine Vielzahl von Themen behandelt, darunter der Einsatz künstlicher Intelligenz zur Unterstützung der Pharmakovigilanz, Risiken von Arzneimitteln während der Schwangerschaft und die Vorbereitung von Bewertungsteams auf Krisensituationen.

29. – 31. Mai 2024
WGEO
Die Working Group of Enforcement Officers (WGEO) brachte Vollzugsbeamte aus ganz Europa zusammen, um Erfahrungen und Informationen im Kampf gegen illegale und gefälschte Arzneimittel auszutauschen.
Auf der Tagesordnung standen eine Präsentation der belgischen Durchsetzungsmaßnahmen sowie eine Sitzung zum Thema Online-Werbung und -Verkauf sogenannter „Hot Medicines“ wie Ozempic und Botox. Diese Zusammenarbeit trägt direkt zum Schutz der Volksgesundheit bei.

4. – 5. Juni 2024
SAWP-CHMP
Die Co-ordination Group for Mutual Recognition and Decentralised Procedures – Human (CMDh) spielt weiterhin eine Schlüsselrolle bei der Verbesserung der Arzneimittelzulassungsverfahren in Europa.
Zu den Themen der Tagung gehörten die Überprüfung der europäischen Arzneimittelgesetzgebung, die Überwachung von Arzneimittelengpässen und der Austausch von Erfahrungen mit nationalen Arzneimitteldatenbanken.

11. – 12. Juni 2024
CMD-h
Die CMD-h (Co-ordination Group for Mutual Recognition and Decentralised procedures – Human) spielt eine wesentliche Rolle bei der kontinuierlichen Verbesserung des Zulassungsverfahrens für Arzneimittel.
Auf der Tagesordnung standen wichtige Themen wie die Überprüfung der europäischen Arzneimittelgesetzgebung, der Austausch nationaler Erfahrungen, einschließlich nationaler Arzneimitteldatenbanken und die Überwachung von Nichtverfügbarkeit und IncreaseNet: eine gemeinsame Aktion, die darauf abzielt, die Kapazitäten innerhalb des europäischen Netzwerks für Arzneimittelregulierung zu erhöhen.

25. – 26. Juni 2024
HMPWG
Die Homeopathic Medicinal Product Working Group (HMPWG) traf sich, um eine Reihe wichtiger Themen zu besprechen. Auf der Tagesordnung stand die Wiederaufnahme der Arbeit der Untergruppe für die Sicherheit homöopathischer Arzneimittel. Außerdem wurde an einem aktualisierten Frage-Antwort-Dokument gearbeitet, in das die neuesten europäischen Verordnungen über Tierarzneimittel eingearbeitet wurden.

27. – 28. Juni 2024
WGQM
Die Working Group of Quality Managers (WGQM), die zum HMA-Netzwerk gehört, konzentriert sich auf die Erstellung und Verbesserung von Qualitätsrichtlinien für die europäischen Arzneimittelbehörden.
Im Mittelpunkt des Treffens standen die Themen kontinuierliche Verbesserung, Risikomanagement, Prozessoptimierung und Audits – alles entscheidende Elemente, um die Prozesse in Unternehmen effizienter und effektiver zu gestalten.
Schließlich ist eine starke Qualitätskultur die Grundlage für eine zuverlässige und transparente Regulierung.

Der Vorsitz im Rat der Europäischen Union
Bilanz der Präsidentschaf
Gemeinsam für die Gesundheit in Europa: die FAAG während des belgischen Vorsitzes
Vom 1. Januar bis zum 30. Juni 2024 hatte Belgien den Vorsitz im Rat der Europäischen Union inne. Dieses Gremium, in dem die 27 Mitgliedstaaten vertreten sind, bestimmt die politische Richtung und die Prioritäten der Europäischen Union. In diesem Zeitraum organisierte die FAAG mehr als 20 Veranstaltungen und zahlreiche Treffen, um die Zusammenarbeit und den Dialog zwischen den Mitgliedstaaten und mit den europäischen Institutionen zu stärken. Darüber hinaus lieferte die FAAG Fachwissen für mehrere wichtige europäische Initiativen und Projekte. Wir fassen die wichtigsten Ergebnisse zusammen.
Gründung der Critical Medicines Alliance: ein Wendepunkt
Während des belgischen Vorsitzes wurde die Critical Medicines Alliance offiziell ins Leben gerufen. In dieser Allianz arbeiten Interessengruppen aus dem Gesundheitswesen, der Industrie und der Zivilgesellschaft mit Vertretern der europäischen Mitgliedstaaten zusammen, um nachhaltige Lösungen für den Mangel an kritischen Arzneimitteln in Europa zu erarbeiten. Bei kritischen Arzneimitteln handelt es sich um Arzneimittel, für die kein geeignetes alternatives Mittel verfügbar ist und bei denen eine unzureichende Versorgung zu einem ernsthaften Schaden oder drohenden ernsthaften Schaden für die Patientinnen und Patienten führen würde.
Am 28. Februar 2025 veröffentlichte die Critical Medicines Alliance einen strategischen Plan mit einer Reihe von politischen Empfehlungen. Ziel ist es, die Zusammenarbeit zwischen politischen Entscheidungsträgern und Interessengruppen zu fördern sowie ein robustes und reaktionsfähiges System zur Stärkung der Produktion kritischer Arzneimittel zu entwickeln. Der Strategiebericht bildet die Grundlage für den Critical Medicines Act, der derzeit von der Europäischen Kommission ausgearbeitet wird.
Die Critical Medicines Alliance und der kommende Critical Medicines Act markieren einen Wendepunkt in der europäischen Arzneimittelpolitik. Während Engpässe früher hauptsächlich auf nationaler Ebene behoben wurden, entsteht nun eine gemeinsame europäische Politik, die die Resilienz der pharmazeutischen Lieferketten stärkt.
Unser Generalverwalter Hugues Malonne war 2024 stellvertretender Vorsitzender der Critical Medicines Alliance. Die Experten der FAAG waren auch in allen thematischen Arbeitsgruppen des Bündnisses aktiv, um konstruktiv an der Ausarbeitung wirksamer Empfehlungen mitzuwirken.
Die Zukunft der Europäischen Gesundheitsunion
Zur Vorbereitung auf die neue Legislaturperiode der Europäischen Kommission diskutierten die EU-Mitgliedstaaten im Rat der EU über die Zukunft der Europäischen Gesundheitsunion. Dies führte zu Schlussfolgerungen des Rates, die für die Politik des neuen EU-Kommissars für Gesundheit maßgeblich sind.
Die FAAG spielte eine aktive Rolle und wies unter anderem auf folgende Erfordernisse hin: bessere Verfügbarkeit von wichtigen Arzneimitteln und Medizinprodukten, eine Datenbank für unerfüllte Gesundheitsbedürfnisse, mehr Zusammenarbeit bei innovativen Arzneimitteln, verstärkte Bekämpfung der Antibiotikaresistenz durch EU-Richtlinien und Verbesserung des Ökosystems für klinische Studien.
Fortschritte in der Arzneimittelgesetzgebung und -politik
Die FAAG beteiligte sich auch aktiv an den Verhandlungen über die Überarbeitung des europäischen Arzneimittelrechts. Während des belgischen Vorsitzes wurden zahlreiche Fortschritte erzielt, insbesondere in den Bereichen Arzneimittelknappheit und Innovationsanreize, Zugang zu Arzneimitteln, Umwidmung von Arzneimitteln, ungedeckter medizinischer Bedarf, Arzneimittel für seltene Leiden und Kinderarzneimittel.
Als Vorsitzende des Netzwerks der europäischen Arzneimittelbehörden (HMA) organisierte die FAAG während des belgischen Vorsitzes mehrere Treffen zur Arzneimittelpolitik. Dies führte zu konkreten Maßnahmen wie dem Vorschlag an die Europäische Kommission für eine gemeinsame Aktion im Bereich der künstlichen Intelligenz. Das HMA veröffentlichte auch ein Dokument mit Lösungen für eine stärkere und diversifiziertere Lieferkette.
Außerdem fand zum ersten Mal ein gemeinsames Treffen zwischen dem HMA, den National Competent Authorities on Pricing and Reimbursement and Public Healthcare Payers (NCAPR) und der Heads of Health Technology Assessment Agencies Group (HTA HAG) statt. Dieses einzigartige Treffen stärkte den Dialog zwischen den Hauptakteuren im Lebenszyklus von Arzneimitteln.
Auf dem Weg zu einer patientenzentrierten Gesundheitsversorgung
Am 17. und 18. April 2024 organisierten die FAAG, das Landesinstitut für Kranken- und Invalidenversicherung (LIKIV) und das Föderale Fachzentrum für Gesundheitspflege (KCE) eine Konferenz zur Frage, wie ungedeckte gesundheitliche Bedürfnisse als Ausgangspunkt für Politik und Innovation im Gesundheitswesen dienen können. Heutzutage werden Entscheidungen über die Entwicklung oder Vermarktung von Arzneimitteln häufig auf Initiative eines Entwicklers und nicht auf der Grundlage des Patienten und der Gesellschaft getroffen.
In fünf Podiumsdiskussionen sprachen sich die Experten für einen unabhängigen, koordinierten Ansatz zur Ermittlung dieser Bedürfnisse sowie deren Umsetzung in Forschung und Innovation aus. Zu den nächsten Schritten gehören die Schaffung einer europäischen Forschungsinfrastruktur und ein EU-Strategieplan, der die öffentliche Unterstützung und die Regulierung zur Bewältigung der dringendsten gesundheitlichen Herausforderungen mobilisiert.
Von der Theorie zur Praxis: die technischen Sitzungen der FAAG
Während des Vorsitzes organisierte die FAAG mehr als 20 technische Sitzungen und Veranstaltungen. Diese Treffen brachten wertvolle Erkenntnisse und führten zu konkreten Maßnahmen. So arbeiteten beispielsweise verschiedene Interessengruppen zusammen, um die 3Rs − Replace (Vermeidung), Reduce (Verringerung) und Refine (Verbesserung) − bei Tierversuchen zu fördern. Die Ergebnisse werden in die Überarbeitung der Leitlinien der Europäischen Arzneimittelagentur einfließen.
Außerdem fanden mehrere Arbeitsgruppen zu Medizinprodukten statt, in denen die Fortschritte bei der neuen Verordnung über In-vitro-Diagnostika erörtert wurden. Bei einem Treffen mit IT-Direktoren und -Experten ging es darum, wie digitale Systeme die Arzneimittelbehörden besser unterstützen können. Des Weiteren wurde untersucht, wie klinische Studien besser auf die wachsende Vielfalt innerhalb der europäischen Bevölkerung zugeschnitten werden können.
Neben diesen Themen wurden auch viele andere wichtige Fragen erörtert. Dazu gehören Risikomanagement und Audits der Arzneimittelbehörden, Pläne zur Aufrechterhaltung des Geschäftsbetriebs, Informationssicherheit, Kapazitätsausbau bei der Aktenbearbeitung und gemeinsame Kommunikationskampagnen zur korrekten Information der europäischen Bürger. Auch die Zusammenarbeit zwischen den Vollzugsbehörden wurde im Kampf gegen illegale Drogen und Online-Trends wie Ozempic und Botox verstärkt.
Der Vorsitz war eine intensive, aber äußerst fruchtbare Zeit für die FAAG. Der Austausch von Wissen, Erfahrungen und bewährten Verfahren ist nach wie vor unerlässlich für den Schutz und die Verbesserung der Gesundheit der Patienten in Europa. Auch nach dem Vorsitz wird sich die FAAG in diesen Arbeitsgruppen und Ausschüssen weiterhin engagieren.
Der Vorsitz im Rat der Europäischen Union
Ein Blick hinter die Kulissen des EU-Vorsitzes
In der ersten Hälfte des Jahres 2024 hatte Belgien den Vorsitz im Rat der Europäischen Union inne. Für die FAAG bedeutete dies nicht nur eine größere Sichtbarkeit auf der europäischen Bühne, sondern auch eine intensive Zeit der Vorbereitung, Organisation und Zusammenarbeit.
Hinter jeder formellen Veranstaltung und technischen Besprechung steckte viel Engagement, Flexibilität und Teamarbeit. Die Abteilung Internationale Beziehungen spielte dabei eine Schlüsselrolle: von der Mitgestaltung der Politik über die Organisation von Veranstaltungen bis hin zur Förderung der Vision der FAAG auf europäischer Ebene.
In diesem Artikel werfen wir einen Blick hinter die Kulissen und zeigen, wie viel Arbeit die Kolleginnen und Kollegen der FAAG geleistet haben, um die Aktivitäten während des Vorsitzes zu einem Erfolg zu machen. Von der Koordinierung internationaler Treffen bis zum Empfang ausländischer Delegationen haben zahlreiche Mitarbeitende ihren Beitrag geleistet.
In ihren eigenen Worten erzählen sie von den Herausforderungen, die diese einzigartige Zeit mit sich brachte.

Es war meine zweite belgische EU-Ratspräsidentschaft, aber diesmal war ich im Zentrum des Prozesses zur Festlegung der belgischen Prioritäten. Ich leitete die internen Diskussionen und nahm für die Agentur an den Konsultationen mit dem Minister sowie unseren Kolleginnen und Kollegen vom FÖD Gesundheit, Sicherheit der Nahrungsmittelkette und Umwelt, dem LIKIV und dem KCE teil. Das Ergebnis dieses Prozesses war ehrgeizig, aber wir haben die Herausforderung gemeinsam erfolgreich gemeistert.
Wir haben nicht weniger als 21 Sitzungen zur Überarbeitung der Arzneimittelgesetzgebung organisiert, zahlreiche Vorbereitungstreffen koordiniert, das SoHO-Dossier zu den neuen EU-Vorschriften für Stoffe menschlichen Ursprungs abgeschlossen und zur Ausarbeitung und Annahme der Schlussfolgerungen des Rates über die Zukunft der Europäischen Gesundheitsunion beigetragen: ein Europa, das sich kümmert, vorbereitet und schützt.
Die Höhepunkte? Die Konferenz zu den Gesundheitsbedürfnissen, das aufeinanderfolgende gemeinsame Treffen HMA/HTA HAG/NCAPR sowie die informelle Tagung des Rates für öffentliche Gesundheit (EPSCO), unmittelbar gefolgt von der Auftaktveranstaltung der Allianz für kritische Arzneimittel.
Es war eine Zeit intensiver Arbeit, aber auch eine einzigartige Gelegenheit, die europäische Gesundheitsagenda mitzugestalten. Mit einem kleinen, aber motivierten Team haben wir eine Präsidentschaft organisiert, die in Erinnerung bleiben wird. Ich möchte diese Gelegenheit nutzen, um Christine, Joeri, Émilie, Grégoire, Jonathan, Noa und Océane besonders für ihre Arbeit und ihr Engagement zu danken, ebenso wie allen Kolleginnen und Kollegen der FAMHP, die direkt oder indirekt zum Erfolg dieser Präsidentschaft beigetragen haben.
Charles Denonne, Leiter der Abteilung Internationale Beziehungen

Meine erste richtige Arbeitserfahrung begann gleich in voller Aktion: Ab meiner zweiten Woche in der Agentur arbeitete ich mit vor Ort. Als Eventmanagerin war ich zusammen mit dem Team für die Organisation von Veranstaltungen und technischen Sitzungen verantwortlich. Von der Suche nach einem Veranstaltungsort bis hin zu sozialen Aktivitäten und Catering-Reservierungen − alles abgestimmt auf die spezifischen Bedürfnisse der jeweiligen Veranstaltung.
In kurzer Zeit habe ich gelernt, mehrere komplexe Veranstaltungen gleichzeitig zu planen, flexibel mit den Beteiligten zu kommunizieren und schnell Lösungen zu finden.
Es waren intensive Monate, aber ich blicke mit großem Stolz auf sie zurück. Und vor allem bin ich dankbar für das Vertrauen, das mir entgegengebracht wurde, um meine eigenen Ideen umzusetzen.
Noa, Eventmanagerin während des Ratsvorsitzes

Mein erster Job und gleich den Vorsitz zu erleben − das war schon etwas Besonderes. Als Jurist durfte ich das Vorsitzteam innerhalb der FAAG verstärken. Seit anderthalb Jahren beschäftige ich mich intensiv mit diesem Thema, wobei der Schwerpunkt auf der Überarbeitung des Arzneimittelrechts liegt.
Ich habe auch an mehreren Sitzungen teilgenommen, z. B. an der Sitzung der HMA und der gemeinsamen Sitzung mit dem Landesinstitut für Kranken- und Invalidenversicherung (LIKIV) und dem Föderale Fachzentrum für Gesundheitspflege (KCE). Außerdem habe ich verschiedene Dossiers weiterverfolgt, wie z. B. das über die neuen Rechtsvorschriften für SoHo.
Ich habe mich nie gelangweilt: Es gab immer etwas zu tun, von vorbereitenden Analysen bis hin zu intensiven Verhandlungen. Wenn ich es zusammenfassen müsste, war es ein sechsmonatiger Marathon-Sprint − anstrengend, aber unglaublich lehrreich.
Grégoire, Jurist in der Abteilung Internationale Beziehungen

Von der FAAG bin ich an die Ständige Vertretung Belgiens bei der EU abgeordnet, wo ich unser Land in den Arbeitsgruppen für Arzneimittel, Medizinprodukte und Volksgesundheit vertrete.
Während des Vorsitzes leitete ich die Verhandlungen über das Arzneimittelpaket, wobei der Schwerpunkt auf Innovation und der Behebung von Arzneimittelknappheit lag. Außerdem habe ich die Verhandlungen über das SoHO-Dossier zu den neuen EU-Vorschriften über Stoffe menschlichen Ursprungs abgeschlossen. Darüber hinaus habe ich bei der Vorbereitung von Ministerräten und der Gründung der Critical Medicines Alliance mitgewirkt.
Es war eine besonders lehrreiche Zeit, aus der ich sowohl beruflich als auch persönlich viel mitnehmen konnte. Ich bin unglaublich dankbar für die Unterstützung und das Engagement aller Kolleginnen und Kollegen, die dazu beigetragen haben, dies zu ermöglichen.
Joeri, Abgeordneter der Ständigen Vertretung Belgiens bei der EU

Während des Vorsitzes war ich als Eventmanagerin für die praktische Organisation von Sitzungen und Veranstaltungen von A bis Z zuständig. Das bedeutete, dass ich Veranstaltungsorte auswählte, die Logistik organisierte, die Planung in die Hand nahm und mit allen Beteiligten kommunizierte.
Jede Woche von einer anderen Stadt aus zu arbeiten war faszinierend, aber auch eine Herausforderung. Es erforderte viel Flexibilität und hatte Auswirkungen auf meinen Tagesrhythmus und mein Privatleben. Dennoch war es eine sehr bereichernde Erfahrung: Ich habe gelernt, mit Druck umzugehen, perfekt zu planen UND ich bin beruflich gewachsen.
Dieses Projekt hat meine Leidenschaft für das Veranstaltungsmanagement nur noch verstärkt. Ich bin stolz auf das, was wir als Team erreicht haben, und dankbar, dass ich Teil davon sein durfte.
Océane, Eventmanagerin während des Ratsvorsitzes